前 言
本标准代替GB/T 21498—2(08《大豆制品中胰蛋白酶抑制剂活性的测定》
本标准与GB/T 21498—2008相比,主要变化如下:
——标准名称修改为“食品安全国家标准大豆制品中胰蛋白酶抑制剂活性的测定”
———删除了原标准范围中“胰蛋白酶抑制剂活性可以用来表示豆制品的烘烤程度”;
———修改了“原理”
———修改了“试剂和材料”
———删除了“采样”;
———修改了“试样制备”;
———删除了“测定次数”;
———修改了“结果计算”;
———修改了“精密度”;
———删除了“检验报告”;
——删除了附录B。
食品安全国家标准
大豆制品中胰蛋白酶抑制剂活性的测定
1 范围
本标准规定了大豆制品中胰蛋白酶抑制剂活性(TIA)的测定方法。 本标准适用于大豆制品中胰蛋白酶抑制剂活性的测定。
2 原理
胰蛋白酶可与苯甲酰-1「精氨酸-对硝基苯胺(「BAPA)发生反应,生成对硝基苯胺,该物质在 410 nm下有特征吸收。大豆制品中的胰蛋白酶抑制剂可抑制此反应,使吸光度值下降,其下降程度与 胰蛋白酶抑制活性成正比。 采用分光光度计在410 nm 处测定该反应前后的吸光度值,可定量分析胰 蛋白酶抑制剂活性。
3 试剂和 材料
除非另有说明,本方法所用试剂均为分析纯,水为GB/T 6682规定的三级水。
3.1 试剂
3.1.1 盐酸(HC1)。
3.1.2 冰乙酸(CH3COOH)
3.1.3 氢氧化钠(NaOH)。
3.1.4 氯化钙(CaC122H2())。
3.1.5 胰蛋白酶(Trypsin):—20°C 冻藏。
3.1.6苯甲酰-L精氨酸-对硝基苯胺(L-BAPA)。
3.1.7 三羟甲基氨基甲烷[NH2C(CH2 OH)3,Tris]。
3.1.8 二甲亚砜(C2H6OS,DMOS)。
3 .2 试剂配制
3.2.1 盐酸溶液(mol/L:取50 mL盐酸(3.1.1)加入水中,用水稀释至100 mL,混匀。
3.2.2 盐酸溶液(1mol/L):取83 mL盐酸(3.1.)加入水中,用水稀释至1 000 mL,混匀。
3.2.3 盐酸溶液(0. 1mol/L):取8.3 mL盐酸(3.1.1)加入水中,用水稀释至1 000 mL,混匀。
3.2.4 盐酸溶液(0.001 mol/L):取1 mL 1 mol/L盐酸溶液加入水中,用水稀释至1 000 mL,混匀。
3.2.5 乙酸溶液(5.3 mol/L):取30 mL冰乙酸(.1.2)加入水中,用水稀释至100 mL,混匀。
3.2.6 氢氧化钠溶液(0.01 mol/L):称取0.40 g氢氧化钠(3.1.3),溶于500 mL水中,用水稀释 至 1 000 mL。
3.2.7氯化钙盐酸溶液:称取0.735 g氯化钙(.1.4)溶解于1 L 0.001 mol/L盐酸溶液中,用1 mol/L 盐酸溶液和0. mol/L盐酸溶液调节pH至3.0±0.。
3.2.8胰蛋白酶储备液(0.270 mg/mL):将胰蛋白酶(.15)放置至室温,称取胰蛋白酶27.0 mg于小 烧杯中,用氯化钙盐酸溶液(3.2.7)溶解,转移至100 mL容量瓶中,以氯化钙盐酸溶液(3.2.7)定容至刻 度。保存于0 °C4 °C冰箱中,最多可使用5 d。
3.2.9胰蛋白酶使用液(0.013 5 mg/mL):用移液管量取5.0 mL胰蛋白酶储备液(.2.8)于100 mL容 量瓶中,用氯化钙盐酸溶液(3.2.7)定容至刻度
3.2.10三羟甲基氨基甲烷-氯化钙缓冲液:称取6.05 g三羟甲基氨基甲烷(.1.7)和0.735 g氯化钙 (3.14)溶于预先加入900 mL水的带有刻度的1 000 mL烧杯中,用1 mol/L盐酸溶液和0.1 mol/L盐 酸溶液调节pH值至8.2士0.,加水至1 000 mL。
3.2.11 L-BAPA溶液:称取60 mg L-BAPA(.1.6)用1 mL二甲亚砜(3.18)溶解,用三羟甲基氨基甲 烷-氯化钙缓冲溶液(.2.10)转移至100 mL容量瓶中,稀释至刻度。用时现配。
4 仪器和设备
4.1 可见分光光度计。
4.2 分析天平:感量分别为0.01 g、0.001 g、.0.000 1 g。
4.3 酸度计:精度为0.05。
4.4 离心机:转速上4 000 r/min。
4.5涡旋振荡器 。
4.6恒温水浴锅:精度为±0. C。
4 分析步骤
5.1 试 样 制 备
对于粉末状样品,取有代表性的样品至少200g,充分混匀后备用。对于块状或颗粒状样品,取有代 表性的样品至少200 g,粉碎至425 μm以下,充分混匀备用。粉碎过程中避免样品过热。
5.2 样品提取
称取1 g~10 g(精确至0.001 g)制备好的试样(.1)于100 mL锥形瓶中,加入50 mL 0.01 mol/L 氢氧化钠溶液,摇匀。用1 mol/L盐酸溶液和0. mol/L盐酸溶液调节pH至9.5士0.1,置于0 C 4 C冰箱中静置15 h~24 h。
将样品提取液取出放置至室温,转移至100 mL容量瓶中,用水定容至刻度,摇匀。经过15 min的 沉淀后,根据需要对样品提取液进行稀释。稀释度取决于预期的样品TIA值。将提取液保存于0C 4 C冰箱中,可保存1 d。
4.3 样品提取液稀释
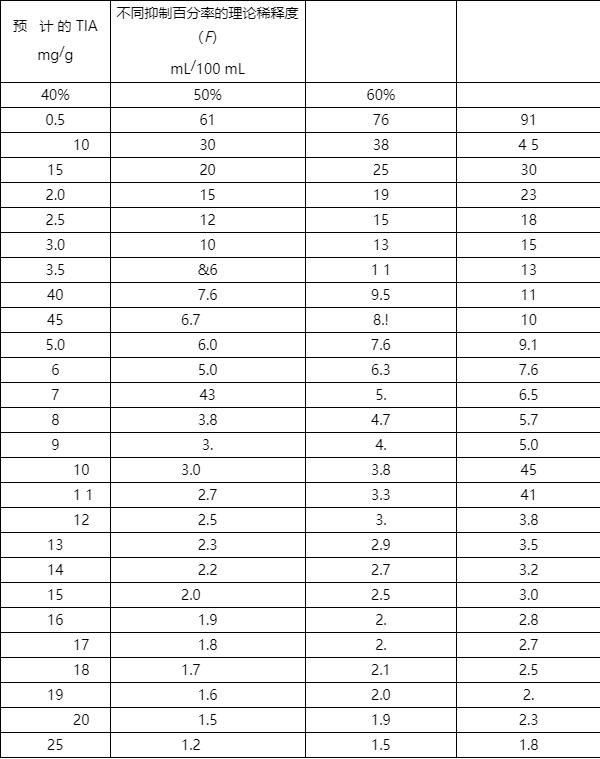
参照附录A中表A.的稀释方案,将样品提取液稀释三个不同稀释浓度,确保在三个抑制百分率 中至少有一个TIA值的测定结果在40%~60%之间。
如果三个测定结果均没有在此范围内, 则需要改变稀释度重新测定。
4.4 胰蛋白酶使用液活性测定
依据表1 吸取一定量的溶液分别加入至两个10 mL 离心管中。
表 1 胰蛋白酶使用液活性测定时各溶液加入量 单位为毫升
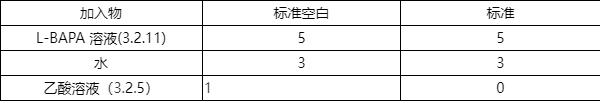
用涡旋振荡器(4.5)混匀离心管中的溶液,置于37 C恒温水浴锅(.6)中,保温10 min。
在空白管中和标准管中各加入1 mL胰蛋白酶使用液(3.2.9),用涡旋振荡器(4.5)将试管内溶液混 匀。将离心管放回到恒温水浴锅(4.6)中。在37C水浴中保温10 min±5 s后。在标准管中加入1mL 乙酸溶液(3.2.5),用涡旋振荡器(4.5)混匀
将离心管置于离心机(.4)中,以4 000 r/min的速度离心10 min。
采用可见分光光度计(.),于410 nm波长,用10 mm比色皿,以水调零,测定上清液的吸光度。 该溶液应在2 h内保持稳定,胰蛋白酶使用液的吸光度和空白液的吸光度之间的差值(A, —AQ为 0.380±0.050 时,可以使用。 否则,需重新配制胰蛋白酶使用液。 必要时,取用一瓶新鲜的胰蛋白酶。
5 .5 胰蛋白酶抑制剂活性的测定
按表2分别吸取一定量的四种溶液分别加入至四个10 mL离心管中。 每一样品的试样稀释液(5.3)均需准备相应的空白溶液。 样品提取液和相应的空白溶液在测定过 程中应同时进行操作(包括离心步骤) 。
表 2 胰蛋白酶抑制剂活性测定时各溶液加入量 单位为毫升
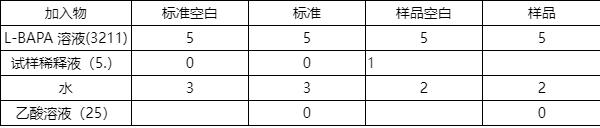
用涡旋振荡器(4.5)混匀离心管中的溶液,并置于37 C恒温水浴锅(.6)中,保温10 min。
在四个离心管中各加入1 mL胰蛋白酶使用液(.2.9)。用涡旋振荡器将管内溶液混匀后,将试管 放回到恒温水浴锅(.6)中。在37 C水浴中保温10 min±5 s后,在标准试管中和样品管中加入1 mL 乙酸溶液(3.2.5),混匀。
将离心管置于离心机(4.4)中,以4 000 r/min速度离心10 min。
采用可见分光光度计(.),于410 nm波长,用10 mm比色皿,以水调零,测定上清液的吸光度。 该溶液可在2 h内保持稳定。
6分析结果的表述
6.1样品提取液的抑制率
样品提取液的抑制率按式(1)计算:

6 .2 胰蛋白酶抑制剂活性
胰蛋白酶抑制剂活性按式()计算,以每克样品抑制胰蛋白酶毫克数(mg/g)表示:
式中:
TIA——胰蛋白酶抑制剂活性,单位为毫克每克(mg/g);
i ———抑 制 百分率;
100%———换算系数;
p -------- 胰蛋白酶使用液的质量浓度,单位为毫克每毫升(mg/mL);
f ——5.6X1 03,该数值是满足本实验胰蛋白酶活性条件下(5.4)的胰蛋白酶纯度折算系数;
m -------- 试样的质量,单位为克(g);
F ——样品提取液的稀释度(表A.所示理论稀释度,mL/100 mL)
计算结果精确至0. mg/g。
7 精密度
在重复性条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
8 其他
本方法的检出限为0.5 mg/g。
附 录 A
样品提取液稀释方案
样品提取液的稀释方案见表A.。
表 A.1 样品提 取液的 稀释表
最后更新时间:2026-02-25 10:55:19